 2020年高考化学一轮复习3.1碱金属元素_钠教案含解析
2020年高考化学一轮复习3.1碱金属元素_钠教案含解析
《2020年高考化学一轮复习3.1碱金属元素_钠教案含解析》由会员分享,可在线阅读,更多相关《2020年高考化学一轮复习3.1碱金属元素_钠教案含解析(10页珍藏版)》请在七七文库上搜索。
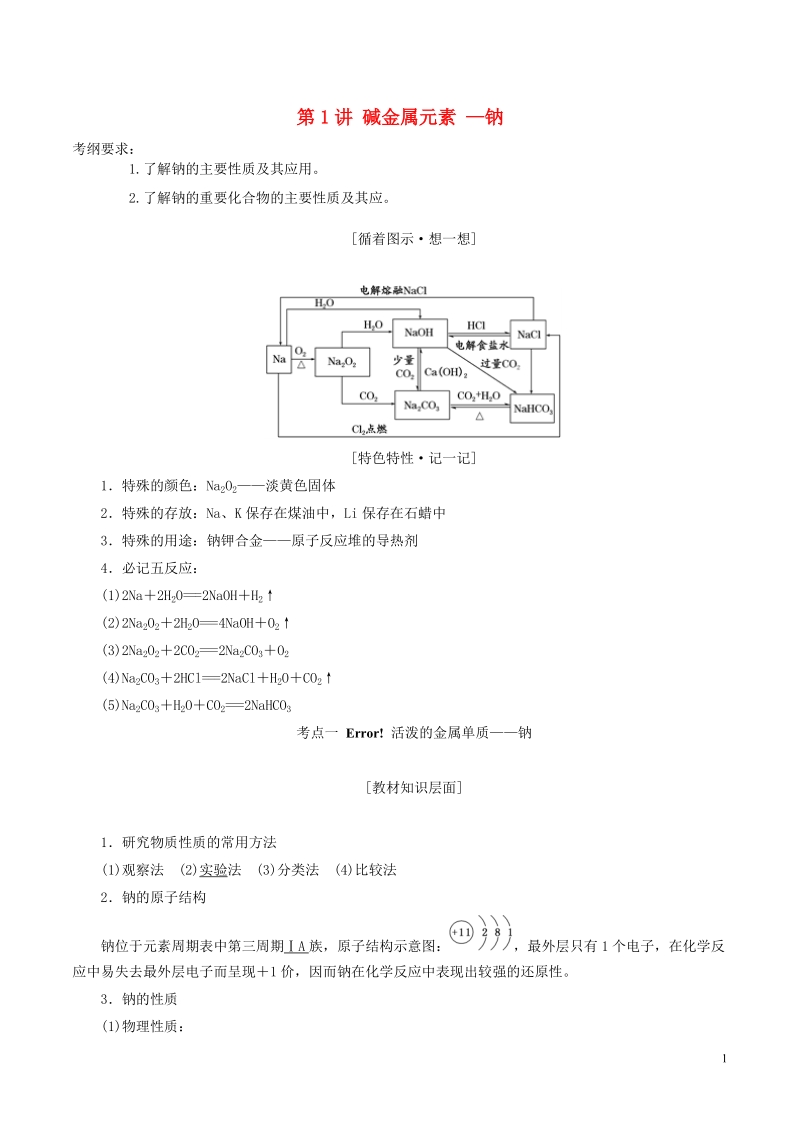
1、第1讲 碱金属元素 钠考纲要求: 1.了解钠的主要性质及其应用。2.了解钠的重要化合物的主要性质及其应。循着图示想一想特色特性记一记1特殊的颜色:Na2O2淡黄色固体2特殊的存放:Na、K保存在煤油中,Li保存在石蜡中3特殊的用途:钠钾合金原子反应堆的导热剂4必记五反应:(1)2Na2H2O=2NaOHH2(2)2Na2O22H2O=4NaOHO2(3)2Na2O22CO2=2Na2CO3O2(4)Na2CO32HCl=2NaClH2OCO2(5)Na2CO3H2OCO2=2NaHCO3考点一 活泼的金属单质钠教材知识层面1研究物质性质的常用方法(1)观察法(2)实验法(3)分类法(4)比较法
2、2钠的原子结构钠位于元素周期表中第三周期A族,原子结构示意图:,最外层只有1个电子,在化学反应中易失去最外层电子而呈现1价,因而钠在化学反应中表现出较强的还原性。3钠的性质(1)物理性质:颜色熔点硬度密度导电导热性银白色低小比水的小比煤油的大良好(2)化学性质:与非金属单质(如O2、Cl2)的反应与O2反应与水的反应:a化学方程式:2Na2H2O=2NaOHH2。b与滴加酚酞的水反应的现象与解释:4钠的制备、保存与用途(1)制备:电解熔融氯化钠,化学方程式为2NaCl电解,2NaCl2。(2)保存:密封保存,通常保存在石蜡油或煤油中。(3)用途:钠钾合金(液态)可用于原子反应堆的导热剂;作强还
3、原剂,将某些稀有金属从它们的卤化物中还原出来,如4NaTiCl4Ti4NaCl;用作电光源,制作高压钠灯。高考考查层面命题点1钠与盐溶液的反应(1)钠投入到NaCl溶液中,只有氢气放出。2Na2H2O=2NaOHH2。(2)钠投入到CuSO4溶液中,产生蓝色沉淀。2Na2H2OCuSO4=Cu(OH)2Na2SO4H2。(3)钠投入到铵盐(如NH4Cl)溶液中,有H2和NH3逸出。2Na2H2O=2NaOHH2,NH4ClNaOH=NaClNH3H2O。典题示例金属钠分别与下列溶液反应时,既有沉淀析出,又有气体逸出的是()ABaCl2溶液BK2SO4溶液CCuSO4溶液 DNH4NO3溶液解析
4、:选C因为是溶液中的反应,所以都有H2产生,NH4NO3溶液还产生NH3,CuSO4溶液还产生Cu(OH)2沉淀。命题点2焰色反应(1)概念:很多金属或它们的化合物在灼烧时都会使火焰呈现特殊颜色的现象。属于元素的物理性质。(2)操作步骤:铂丝无色待测物观察火焰颜色铂丝无色。(3)常见元素焰色反应的颜色:钠元素:黄色;钾元素:紫色(透过蓝色钴玻璃观察)。典题示例用光洁的铂丝蘸取某无色溶液在无色火焰上灼烧,直接观察到火焰呈黄色,下列各判断正确的是()A只含有NaB一定含有Na,可能含有KC既含有Na,又含有KD可能含有Na,可能还含有K解析:选BNa元素的焰色为黄色,而K元素的焰色为紫色,而且黄色
5、会干扰紫色,所以不能判断是否含有K元素。考点达标层面1判断下列描述的正误(正确的打“”,错误的打“”)。(1)将钠块放入水中,产生气体的方程式为2Na2H2O=2NaOHH2。()(2)钠表面自然形成的氧化层能够保护内层金属不被空气氧化。()(3)钠与CuSO4溶液的反应:2NaCu2=Cu2Na。()(4)1 mol Na被完全氧化生成Na2O2,失去2NA个电子。()(5)钠与足量O2反应生成Na2O,随着温度的升高,生成Na2O的速率逐渐加快。()(6)焰色反应是大多数金属元素的性质,属于化学变化。()(7)金属钠可以保存在CCl4中。()(8)钠、钾着火后,用水或泡沫灭火器可迅速灭火。
6、()答案:(1)(2)(3)(4)(5)(6)(7)(8)2取一小块金属钠,放在燃烧匙里加热,下列现象描述正确的是()金属先熔化在空气中燃烧,放出黄色火花燃烧后得白色固体燃烧时火焰为黄色燃烧后生成淡黄色固体物质ABCD答案:C考点二 钠的氧化物氧化钠和过氧化钠教材知识层面物质氧化钠(Na2O)过氧化钠(Na2O2)颜色状态白色固体淡黄色固体类别碱性氧化物过氧化物氧元素化合价21化学键类型只有离子键有离子键和共价键电子式Na2NaNa2Na与水反应Na2OH2O=2NaOH2Na2O22H2O=4NaOHO2与CO2反应Na2OCO2=Na2CO32Na2O22CO2=2Na2CO3O2与盐酸反
7、应Na2O2HCl=2NaClH2O2Na2O24HCl=4NaCl2H2OO2主要用途可制烧碱漂白剂、消毒剂、供氧剂保存密封密封、远离易燃物高考考查层面命题点1过氧化钠的强氧化性1从元素化合价角度分析Na2O2的性质 2强氧化性的五个表现典题示例1在溶液中加入足量的Na2O2后仍能大量共存的离子组是()ANa、Fe2、Cl、SOBK、Al(OH)4、Cl、SOCCa2、Mg2、NO、HCODNa、Cl、CO、SO解析:选BNa2O2具有强氧化性,能将Fe2氧化成Fe3,能将SO氧化成SO,A、D两项不能共存;Na2O2与水反应生成NaOH,C项中的Mg2、HCO与OH不能大量共存。2下列关于
8、Na2O2的说法正确的是()ANa2O2与SO2反应生成Na2SO3和O2BNa2O2投入到酚酞溶液中,溶液变红CNa2O2能与酸反应生成盐和水,所以Na2O2是碱性氧化物DNa2O2与水反应,Na2O2既是氧化剂,又是还原剂解析:选DNa2O2具有强氧化性,与SO2反应生成Na2SO4而不是Na2SO3,A错误;Na2O2投入到酚酞溶液中,溶液先变红后退色,B错误;Na2O2不属于碱性氧化物而属于过氧化物,C错误。命题点2Na2O2与水、CO2反应的四个重要关系1物质的量的关系无论是CO2或H2O(g)的单一物质还是二者的混合物,与足量的Na2O2反应时,消耗CO2或H2O(g)与放出O2的


- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 2020 年高 化学 一轮 复习
 七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。



 浙公网安备33030202001339号
浙公网安备33030202001339号
链接地址:https://www.77wenku.com/p-103941.html