 (通用版)2020高考化学二轮复习题型一化学实验综合题的研究大题突破教案
(通用版)2020高考化学二轮复习题型一化学实验综合题的研究大题突破教案
《(通用版)2020高考化学二轮复习题型一化学实验综合题的研究大题突破教案》由会员分享,可在线阅读,更多相关《(通用版)2020高考化学二轮复习题型一化学实验综合题的研究大题突破教案(35页珍藏版)》请在七七文库上搜索。
1、化学实验综合题的研究大题突破考向突破一以物质制备为载体的综合实验题1无机物制备题的常考方向2有气体参与的制备实验的注意事项(1)操作顺序问题与气体有关的实验操作顺序:装置选择与连接气密性检查装入固体药品加液体药品按程序实验拆卸仪器。(2)加热操作的要求使用可燃性气体(如H2、CO、CH4等),先用原料气赶走系统内的空气,再点燃酒精灯加热,以防止爆炸。制备一些易与空气中的成分发生反应的物质(如H2还原CuO的实验),反应结束时,应先熄灭酒精灯,继续通原料气至试管冷却。(3)尾气处理的方法有毒气体常采用溶液(或固体)吸收或将之点燃的方法,不能直接排放。(4)特殊实验装置制备在空气中易吸水、潮解以及
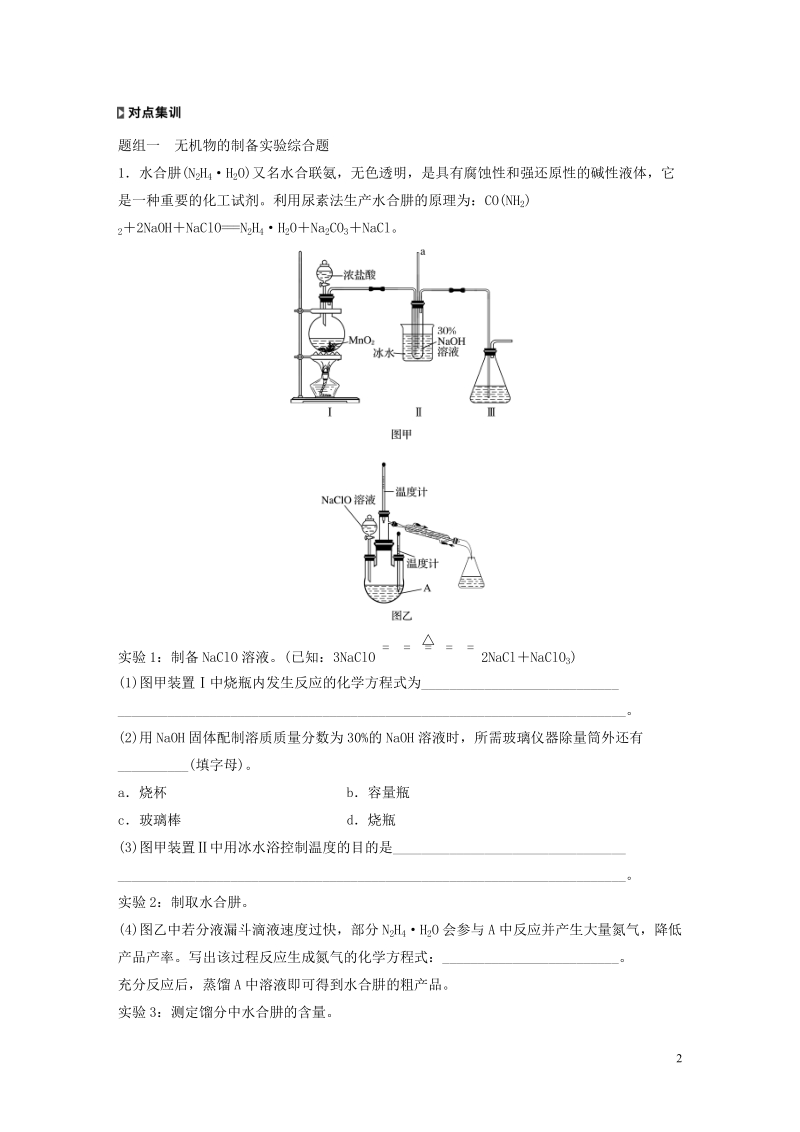
2、水解的物质(如Al2S3、AlCl3等),往往在装置的末端再接一个干燥装置,以防止空气中水蒸气的进入。用液体吸收气体,若气体溶解度较大,要加防倒吸装置。若制备物质易被空气中氧气氧化,应加排空气装置。3有机物制备实验综合题设问角度及过程分析涉及有机物制取的综合实验,重点考查物质分离中的蒸馏、分液操作,反应条件的控制,产率的计算等问题。题组一无机物的制备实验综合题1水合肼(N2H4H2O)又名水合联氨,无色透明,是具有腐蚀性和强还原性的碱性液体,它是一种重要的化工试剂。利用尿素法生产水合肼的原理为:CO(NH2)22NaOHNaClO=N2H4H2ONa2CO3NaCl。实验1:制备NaClO溶液
3、。(已知:3NaClO2NaClNaClO3)(1)图甲装置中烧瓶内发生反应的化学方程式为_。(2)用NaOH固体配制溶质质量分数为30%的NaOH溶液时,所需玻璃仪器除量筒外还有_(填字母)。a烧杯b容量瓶c玻璃棒d烧瓶(3)图甲装置中用冰水浴控制温度的目的是_。实验2:制取水合肼。(4)图乙中若分液漏斗滴液速度过快,部分N2H4H2O会参与A中反应并产生大量氮气,降低产品产率。写出该过程反应生成氮气的化学方程式:_。充分反应后,蒸馏A中溶液即可得到水合肼的粗产品。实验3:测定馏分中水合肼的含量。(5)称取馏分3.0g,加入适量NaHCO3固体(滴定过程中,调节溶液的pH保持在6.5左右),
4、加水配成250 mL溶液,移出25.00 mL置于锥形瓶中,并滴加23滴淀粉溶液,用0.15 molL1的碘的标准溶液滴定(已知:N2H4H2O2I2=N24HIH2O)。滴定时,碘的标准溶液盛放在_(填“酸式”或“碱式”)滴定管中。下列能导致馏分中水合肼的含量测定结果偏高的是_(填字母)。a锥形瓶清洗干净后未干燥b滴定前,滴定管内无气泡,滴定后有气泡c读数时,滴定前平视,滴定后俯视d盛标准液的滴定管水洗后,直接装标准液实验测得消耗I2溶液的平均值为20.00mL,馏分中水合肼(N2H4H2O)的质量分数为_。答案(1)MnO24HCl(浓)MnCl2Cl22H2O(2)ac(3)防止NaCl
5、O受热分解,影响水合肼的产率(4)N2H4H2O2NaClO=N23H2O2NaCl(5)酸式d25%解析(2)配制一定质量分数的溶液不用容量瓶和烧瓶。(4)N2H4H2O被NaClO氧化为N2,NaClO的还原产物是NaCl,据此可写出氧化还原反应的方程式。(5)碘液能腐蚀橡胶,应选用酸式滴定管。a项无影响;b项滴定后有气泡,读取体积偏小;c项俯视读数时,体积偏小,测定结果偏小;d项读取体积偏大。2I2N2H4H2O01520103mol0.1520103mol则水合肼的质量分数100%25%。2二氯化二硫(S2Cl2)可作硫化剂、氯化剂。常温下是一种黄红色液体,沸点137,在潮湿的空气中剧
6、烈水解而发烟。S2Cl2可通过硫与少量氯气在110140反应制得,氯气过量则会生成SCl2。(1)选用以下装置制取少量S2Cl2(加热及夹持装置略):仪器m的名称为_。装置连接顺序:A_。A中发生反应的化学方程式为_。B中玻璃纤维的作用是_。D中的最佳试剂是_(填字母)。a碱石灰b浓硫酸cNaOH溶液d无水氯化钙(2)S2Cl2遇水剧烈水解,生成SO2、HCl和一种常见的固体。该固体是_。甲同学为了验证两种气体产物,将水解生成的气体依次通过硝酸银与稀硝酸的混合溶液、品红溶液、NaOH溶液,该方案_(填“可行”或“不可行”),原因是_。(3)乙同学按如下实验方案检验S2Cl2是否含有杂质:取1.
7、25g产品,在密闭容器中依次加入足量水、双氧水、Ba(NO3)2溶液,过滤;往的滤液中加入足量AgNO3溶液,过滤、洗涤、干燥,称得固体质量为2.87g。则产品中氯元素的质量分数为_,由此可知产品中_(填“含有”或“不含有”)SCl2杂质。答案(1)直形冷凝管CBEDMnO24HCl(浓)MnCl2Cl22H2O增大硫与氯气的接触面积,加快反应速率a(2)S(或硫)不可行SO2易被硝酸氧化生成SO,既难于检验SO2,又干扰HCl的检验(3)56.8%含有解析(1)制取少量S2Cl2:装置A制备氯气,装置C除去氯气中混有的水蒸气,B中发生氯气与硫单质的反应,装置E冷凝并收集产物,装置D用于吸收未
8、反应完的氯气和阻止空气中的水蒸气进入收集装置。(2)S2Cl2遇水剧烈水解,生成SO2、HCl和一种常见的固体,S2Cl2SO2,硫元素化合价升高,根据氧化还原反应中化合价有升有降,则该固体为S单质。二氧化硫被氧化为硫酸根离子,硫酸银微溶,会干扰氯离子的检验。(3)S2Cl2中氯元素的质量分数为100%52.6%,SCl2中氯元素的质量分数为100%68.9%,样品中的氯元素质量由AgCl固体计算,与之比较即可。3过氧化钙(CaO2)是白色固体,易溶于酸,难溶于水、乙醇等,可用作分析试剂、医用防腐剂以及消毒剂等。实验1:制备过氧化钙(CaO2)某实验小组拟选用如图甲所示装置(部分固定装置略)制
9、备过氧化钙(CaO2)。(1)请选择必要的装置,按气流方向的连接顺序为_(填仪器接口的字母编号,装置可重复使用)。(2)实验步骤:检验装置的气密性后,装入药品;打开分液漏斗活塞,通入一段时间气体,加热药品;反应结束后,先熄灭酒精灯,待反应管冷却至室温后,停止通入气体;拆除装置,取出产物。步骤的操作目的是_。实验2:制备CaO28H2O利用反应Ca2H2O22NH38H2O=CaO28H2O2NH,在碱性环境下制取CaO28H2O的装置如图乙所示:(3)装置A中发生反应的化学方程式为_;NH3在Ca2和H2O2的反应过程中所起的作用是_。(4)仪器C的名称为_;反应结束后,经_(填操作名称)、洗
10、涤、低温烘干可获得CaO28H2O。检验CaO28H2O是否洗涤干净的操作为_。(5)装置B中用冰水浴控制温度,其可能原因是_。(6)测定产品CaO28H2O的含量:准确称取a g产品放入锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 molL1硫酸溶液,充分反应;向上述锥形瓶中加入几滴_(填指示剂名称);逐滴加入浓度为cmolL1的Na2S2O3溶液,滴定至终点,记录数据,重复上述操作2次,得出三次平均消耗Na2S2O3溶液的体积为VmL,则CaO28H2O的质量分数为_(写出表达式即可)。(已知:I22S2O=2IS4O)答案(1)dfebc(或cb)fegh(2)防止倒吸
11、(3)Ca(OH)22NH4ClCaCl22NH32H2O中和过氧化氢和Ca2反应生成的H,促进反应进行(或使溶液呈碱性,减少CaO28H2O的溶解,或提高产品的产率等,其他合理答案均可)(4)分液漏斗过滤取最后一次洗涤液少量于试管中,先加入稀硝酸酸化,再滴加AgNO3溶液,若不产生白色沉淀,说明沉淀已经洗涤干净;反之则说明未洗涤干净(5)减少过氧化氢的分解,提高过氧化氢的利用率(或反应放热,温度低有利于提高产率)(6)淀粉溶液100%解析(1)过氧化钙的制备过程中涉及装置的用途有:制取O2除去H2O(g)O2与钙在高温下反应制备过氧化钙防止空气中的H2O(g)、CO2等进入装置,故仪器接口的
12、连接顺序为dfebcfegh或dfecbfegh。(2)步骤反应结束后,先熄灭酒精灯,待反应管冷却至室温后,停止通入气体,其目的是防止倒吸。(3)装置A中利用熟石灰与氯化铵共热制取氨气,发生反应的化学方程式为Ca(OH)22NH4ClCaCl22NH32H2O。在Ca2和H2O2反应过程中,NH3溶于水生成NH3H2O能中和过氧化氢和Ca2反应生成的H,促进反应进行。(4)仪器C的名称为分液漏斗;反应结束后,经过滤、洗涤、低温烘干可获得CaO28H2O。检验CaO28H2O是否洗涤干净,可检验最后一次洗涤液中是否含有Cl,即加入稀硝酸、AgNO3溶液进行检验。(5)装置B中用冰水浴控制温度,其
13、可能原因是温度低可减少过氧化氢的分解,提高过氧化氢的利用率或反应放热,温度低有利于提高产率。(6)过氧化钙将KI氧化成I2,再利用cmolL1的Na2S2O3溶液滴定生成的I2,故可加入淀粉溶液作指示剂。根据得失电子守恒可得关系式:CaO28H2OI22S2O216g2molmgcV103mol则有mg108cV103g,故产品中CaO28H2O的质量分数为100%。题组二有机物制备综合实验题4某化学兴趣小组设计实验制备苯甲酸异丙酯,其反应原理为H2O。用如图所示装置进行实验:物质的部分物理性质如表所示:物质相对分子质量密度/ gcm3沸点/水溶性苯甲酸1221.27249微溶异丙醇600.7
14、982易溶苯甲酸异丙酯1641.17218不溶实验步骤:步骤.在干燥的仪器a中加入38.1g苯甲酸、30mL异丙醇和15mL浓硫酸,再加入几粒沸石;步骤.加热至70左右,保持恒温半小时;步骤.将仪器a中液体进行如下所示操作得到粗产品:步骤.将粗产品用图乙所示装置进行精制。试回答下列问题:(1)步骤中加入三种试剂的先后顺序一定错误的是_(填字母)。A异丙醇、苯甲酸、浓硫酸B浓硫酸、异丙醇、苯甲酸C异丙醇、浓硫酸、苯甲酸(2)图甲中仪器a的名称为_。加入的苯甲酸和异丙醇中,需过量的是_,目的是_。(3)本实验一般采用水浴加热,因为温度过高会使产率_(填“增大”“减小”或“不变”)。(4)操作中第二
15、次水洗的目的是_,操作中加入无水硫酸镁的作用为_。(5)步骤所用的装置中冷却水的进口为_(填字母),操作时应收集218的馏分,如果温度计水银球偏上,则收集的精制产品中可能混有的杂质为_(填物质名称)。(6)如果得到的苯甲酸异丙酯的质量为40.930g,则该实验的产率为_%(结果保留2位有效数字)。思路点拨提取信息并与实验知识相结合答案(1)B(2)三颈烧瓶(或三口烧瓶)异丙醇有利于酯化反应向正反应方向进行,提高苯甲酸的转化率(3)减小(4)除去残留的碳酸钠除去残留的水(5)g苯甲酸(6)80解析(6)38.1g苯甲酸的物质的量为0.312mol,30mL异丙醇的物质的量为0.395 mol,异
16、丙醇过量,所以苯甲酸异丙酯的理论产量为0.312mol164gmol151.168g,则产率为100%80%。5醋酸亚铬水合物Cr(CH3COO)222H2O,相对分子质量为376是一种深红色晶体,不溶于冷水,是常用的氧气吸收剂。实验室中以锌粒、三氯化铬溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示,且仪器2中预先加入锌粒。已知二价铬不稳定,极易被氧气氧化,不与锌反应。制备过程中发生的相关反应如下:Zn(s)2HCl(aq)=ZnCl2(aq)H2(g)2CrCl3(aq)Zn(s)=2CrCl2(aq)ZnCl2(aq)2Cr2(aq)4CH3COO(aq)2H2O(l)
17、=Cr(CH3COO)222H2O(s)请回答下列问题:(1)仪器1的名称是_。(2)往仪器2中加盐酸和三氯化铬溶液的顺序最好是_(填字母);目的是_。A盐酸和三氯化铬溶液同时加入B先加三氯化铬溶液一段时间后再加盐酸C先加盐酸一段时间后再加三氯化铬溶液(3)为使生成的CrCl2溶液与CH3COONa溶液顺利混合,应关闭止水夹_(填“A”或“B”,下同),打开止水夹_。(4)本实验中锌粒要过量,其原因除了让产生的H2将CrCl2溶液压入装置3中与CH3COONa溶液反应外,另一个作用是_。(5)已知其他反应物足量,实验时取用的CrCl3溶液中含溶质9.51 g,取用的醋酸钠溶液为1.5L0.1m
18、olL1;实验后得干燥纯净的Cr(CH3COO)222H2O9.48g,则该实验所得产品的产率为_(不考虑溶解的醋酸亚铬水合物)。思路分析(1)实验过程分析:Cr2不稳定,极易被O2氧化,让锌粒与盐酸先反应产生H2,把装置2和3中的空气赶出,避免生成的Cr2被氧化;还有一个作用是利用生成氢气,使装置内气压增大,将CrCl2溶液压入装置3中与CH3COONa溶液顺利混合;装置2中锌粒要过量,除了让产生的H2将CrCl2溶液压入装置3与CH3COONa溶液反应外,另一个作用是:过量的锌与CrCl3充分反应得到CrCl2。(2)产率计算:题目中给了CrCl3的质量和CH3COONa的物质的量,注意C


- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 通用版 2020 高考 化学 二轮 复习 题型 实验 综合 研究 突破 教案
 七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。



 浙公网安备33030202001339号
浙公网安备33030202001339号
链接地址:https://www.77wenku.com/p-107409.html