 第3部分 第3讲 水和溶液-2021届浙教版中考科学一轮复习讲解部分
第3部分 第3讲 水和溶液-2021届浙教版中考科学一轮复习讲解部分
《第3部分 第3讲 水和溶液-2021届浙教版中考科学一轮复习讲解部分》由会员分享,可在线阅读,更多相关《第3部分 第3讲 水和溶液-2021届浙教版中考科学一轮复习讲解部分(9页珍藏版)》请在七七文库上搜索。
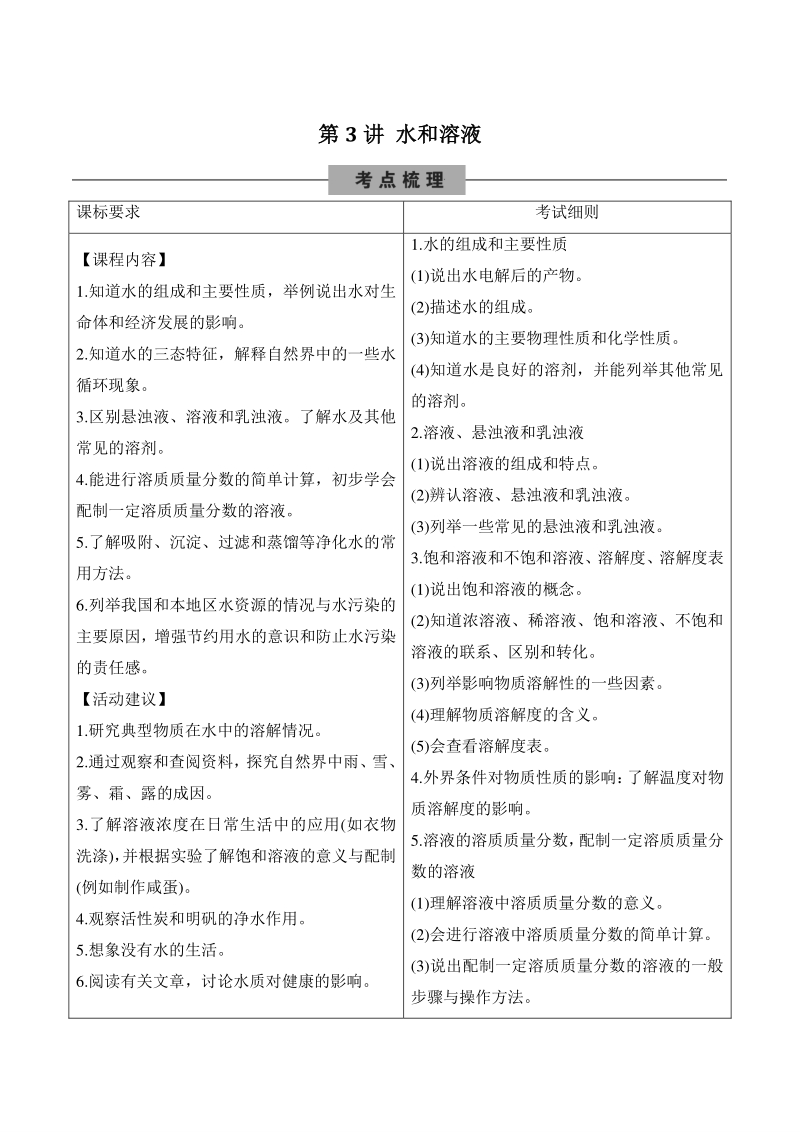
1、第第 3 讲讲 水和溶液水和溶液 课标要求 考试细则 【课程内容】 1.知道水的组成和主要性质,举例说出水对生 命体和经济发展的影响。 2.知道水的三态特征,解释自然界中的一些水 循环现象。 3.区别悬浊液、溶液和乳浊液。了解水及其他 常见的溶剂。 4.能进行溶质质量分数的简单计算,初步学会 配制一定溶质质量分数的溶液。 5.了解吸附、沉淀、过滤和蒸馏等净化水的常 用方法。 6.列举我国和本地区水资源的情况与水污染的 主要原因,增强节约用水的意识和防止水污染 的责任感。 【活动建议】 1.研究典型物质在水中的溶解情况。 2.通过观察和查阅资料,探究自然界中雨、雪、 雾、霜、露的成因。 3.了解
2、溶液浓度在日常生活中的应用(如衣物 洗涤), 并根据实验了解饱和溶液的意义与配制 (例如制作咸蛋)。 4.观察活性炭和明矾的净水作用。 5.想象没有水的生活。 6.阅读有关文章,讨论水质对健康的影响。 1.水的组成和主要性质 (1)说出水电解后的产物。 (2)描述水的组成。 (3)知道水的主要物理性质和化学性质。 (4)知道水是良好的溶剂,并能列举其他常见 的溶剂。 2.溶液、悬浊液和乳浊液 (1)说出溶液的组成和特点。 (2)辨认溶液、悬浊液和乳浊液。 (3)列举一些常见的悬浊液和乳浊液。 3.饱和溶液和不饱和溶液、溶解度、溶解度表 (1)说出饱和溶液的概念。 (2)知道浓溶液、稀溶液、饱和
3、溶液、不饱和 溶液的联系、区别和转化。 (3)列举影响物质溶解性的一些因素。 (4)理解物质溶解度的含义。 (5)会查看溶解度表。 4.外界条件对物质性质的影响: 了解温度对物 质溶解度的影响。 5.溶液的溶质质量分数, 配制一定溶质质量分 数的溶液 (1)理解溶液中溶质质量分数的意义。 (2)会进行溶液中溶质质量分数的简单计算。 (3)说出配制一定溶质质量分数的溶液的一般 步骤与操作方法。 (4)按要求配制溶液,说明有关配制方案。 6.水资源和水污染 (1)描述地球上水体的名称及大致比例。 (2)列举吸附、沉淀、过滤、蒸馏等净化水的 常用方法和简单原理。 (3)树立节约用水的意识,增强防止水
4、污染的 责任感。 (4)体会水是生命之源的观点。 一、 水的组成和主要性质 1水的组成电解水的实验 (1)现象 两个电极上都有气泡产生。 跟电源负极相连的试管内产生的气体的体积约是跟电源正极相连的试管内产生的气体 体积的 2 倍。 (2)检验 用点燃的木条接近负极上产生的气体, 气体能燃烧并产生淡蓝色火焰, 该气体是氢气。 用带火星的木条接近正极上产生的气体,能使带火星的木条复燃,该气体是氧气。 (3)结论 水电解生成氢气和氧气。 水是由氢、氧两种元素组成的。 难点解析:从微观角度分析该实验,还可以得出水分子是由氢原子和氧原子构成的,验证 了化学变化中分子可分而原子不可再分。此实验证明化学反应
5、的实质是分子分裂成原子, 原子 重新结合成新的分子。在相同状况下,相同体积的任何气体含有相同数目的分子。在电解水实 验中,通过生成氢气和氧气的体积比为 21,推出水分子组成中氢原子和氧原子的个数比为 21,经进一步科学确认,得出水的化学式为 H2O。 实验结束后发现产生氧气和氢气的体积比比理论值小, 其原因可能是氧气在水中的溶解度 大于氢气在水中的溶解度,或氧气和电极发生氧化反应。 2水的主要物理性质和化学性质 物理性质 常温、常压下是无色、无味的液体,沸点 100 ,熔点 0 ,密度 一般为 1 g/cm3,是常见的溶剂 化学性质 (1)在常温下化学性质稳定; (2)在通电条件下分解; (3
6、)非金属氧化物水酸:CO2H2O=H2CO3; (4)金属氧化物水碱:CaOH2O=Ca(OH)2; (5)CuSO45H2O=CuSO4 5H2O,白色粉末变蓝,可用于检验水 3.举例说明水对生命体和经济发展的影响。 二、 溶液、悬浊液和乳浊液 1溶液的组成和特点 (1)溶液的概念:一种或几种物质分散到另一种物质里,形成的均一 、稳定的混合物,叫 溶液。 (2)溶液的组成:溶质和溶剂。 注意: 溶液的质量溶质的质量溶剂的质量; 溶液的体积溶质的体积溶剂的体积。 溶液中的溶质可以是固体、液体或气体。当固体、液体或气体溶于水后,水被称为溶剂。例 如,食盐溶液中的溶质是 NaCl;酒精溶液中的溶质
7、是酒精;将氯化氢气体溶于水得到氯化氢 的水溶液,其中 HCl 为溶质,水为溶剂。当溶液中无水时,质量大的为溶剂。例如,碘酒中 的溶剂为乙醇。 难点解析:结晶水合物溶于水时,其溶质指不含水的化合物,结晶水转化成溶剂,如 CuSO4 5H2O 溶解于水,溶质是 CuSO4,而结晶水转化成溶剂。有些化合物溶于水,与水发生 反应,溶质会发生变化。如 CaO 溶于水:CaOH2O=Ca(OH)2,其溶质是 Ca(OH)2而不是 CaO。 (3)溶液的特点 均一性:指溶液各部分的浓度和性质完全相同。 稳定性:指当外界条件不改变时(指溶剂不蒸发,温度或压强不改变),溶液中不会有 溶质析出,即久置不分层。 2
8、溶液、悬浊液、乳浊液的区别 类别 溶液 悬浊液 乳浊液 组成 由溶质和溶剂组成的固体小颗粒和液体组油状小液滴和液体组 混合物 成的混合物 成的混合物 特点 均一、稳定 不均一、不稳定 不均一、不稳定 静置后 现象 不分层、无沉淀,无明 显变化 产生沉淀 产生分层 示例 蔗糖溶液、碘酒、氨水 钡餐、泥浆水 牛奶、肥皂水 难点解析:在溶液中分散的物质存在的形式是分子、原子或离子,在悬浊液中分散的 物质存在的形式是固体小颗粒,在乳浊液中分散的物质存在的形式是小液滴。 3饱和溶液与不饱和溶液 (1)概念:在一定温度下,一定量的溶剂里不能再继续溶解某种溶质的溶液叫作这种溶质 的饱和溶液;在一定温度下,在
9、一定量的溶剂里,还能溶解某种溶质的溶液叫作这种溶质的不 饱和溶液。 (2)相互转化 对大多数溶解度随温度升高而增大的物质(如 KNO3等): 饱和溶液转化为不饱和溶液的 方法:升温、增加溶剂;不饱和溶液转化为饱和溶液的方法:降温、蒸发溶剂、增加溶质。 对于极少数溶解度随温度升高而减小的物质如 Ca(OH)2等:饱和溶液转化为不饱和 溶液的方法:降温、增加溶剂;不饱和溶液转化为饱和溶液的方法:升温、蒸发溶剂、增加溶 质。 难点解析:不饱和溶液转化为饱和溶液,溶质质量分数可以增大,比如通过增加溶质的办 法;溶质质量分数也可以不变,比如溶解度随温度升高而增大的物质通过降低温度,又不析出 固体;溶质质
10、量分数还可以减小,比如溶解度随温度升高而增大的物质通过降低温度,析出固 体。 拓展:“已知某碱溶液的溶解度随温度升高而增大;温度一定时,该碱溶液的浓度越大, 其碱性越强。要使该碱饱和溶液的 pH 升高(溶质不变),可采取的方法是什么?”因为已经是 饱和溶液,所以仅增加溶质或蒸发溶剂都不行,要提高饱和溶液的质量分数需要提高溶解度, 即升高温度且增加溶质,或升高温度且蒸发溶剂。 (3)判断方法 观察法:当溶液底部有剩余溶质存在,且底部剩余溶质的量不再减少时,表明溶液已 饱和; 实验法:当溶液底部无剩余溶质存在时,可向该溶液中加入少量溶质,如果不再溶解 则表明溶液已饱和; 计算法:当确定某种物质在某


- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 第3部分 第3讲 水和溶液-2021届浙教版中考科学一轮复习讲解部分 部分 溶液 2021 届浙教版 中考 科学 一轮 复习 讲解
 七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。



 浙公网安备33030202001339号
浙公网安备33030202001339号
链接地址:https://www.77wenku.com/p-180049.html