 第3部分 第15讲 物质的检验分离与提纯-2021届浙教版中考科学一轮复习讲解部分
第3部分 第15讲 物质的检验分离与提纯-2021届浙教版中考科学一轮复习讲解部分
《第3部分 第15讲 物质的检验分离与提纯-2021届浙教版中考科学一轮复习讲解部分》由会员分享,可在线阅读,更多相关《第3部分 第15讲 物质的检验分离与提纯-2021届浙教版中考科学一轮复习讲解部分(9页珍藏版)》请在七七文库上搜索。
1、第第 15 讲讲 物质的检验、分离与提纯物质的检验、分离与提纯 课标要求 考试细则 【课程内容】 区别纯净物和混合物,初步学会混合物的分 离技能(过滤、蒸发、结晶和纸层析等)。 【活动建议】 利用物质的性质分离和鉴别不同的物质,例 如利用密度鉴别空心球和实心球,利用溶解 性去除食盐中的杂质。 1.学会混合物分离的主要方法(过滤、蒸发)及 操作要点。 2.说明粗盐提纯的过程。 3.说出氢气和一氧化碳的可燃性, 能根据它们 的燃烧产物来鉴别氢气和一氧化碳。 4.说明检测氧气的方法。 5.说明检验二氧化碳气体的方法。 6.会鉴别氯离子和硫酸根离子, 能区别盐酸和 硫酸。 7.知道一些常见盐的检验方法
2、。 一、 物质的检验 1中学阶段通常的三种类型 (1)鉴定:根据物质的特性,用物理或化学方法对它的组成成分加以确认、证实。对酸、 碱、盐溶液的鉴定,实质是对溶液中的阴、阳离子的鉴定。 (2)鉴别:根据被鉴别的几种物质的性质(物理性质和化学性质)差异及实验时的不同现象 (发光、 放热、变色、放出气体、生成沉淀等),将其一一区别开来。 (3)推断:通过已知的实验事实或相互转化关系,根据物质的性质、反应的现象推断出被 检验的物质的成分。 2物质检验的原则 操作简便,现象明显,方法恰当。 3物质检验的方法 (1)物理方法:根据物理性质进行观察、实验、分析、判断,得出结论,如密度法、导电 法、观察法、气
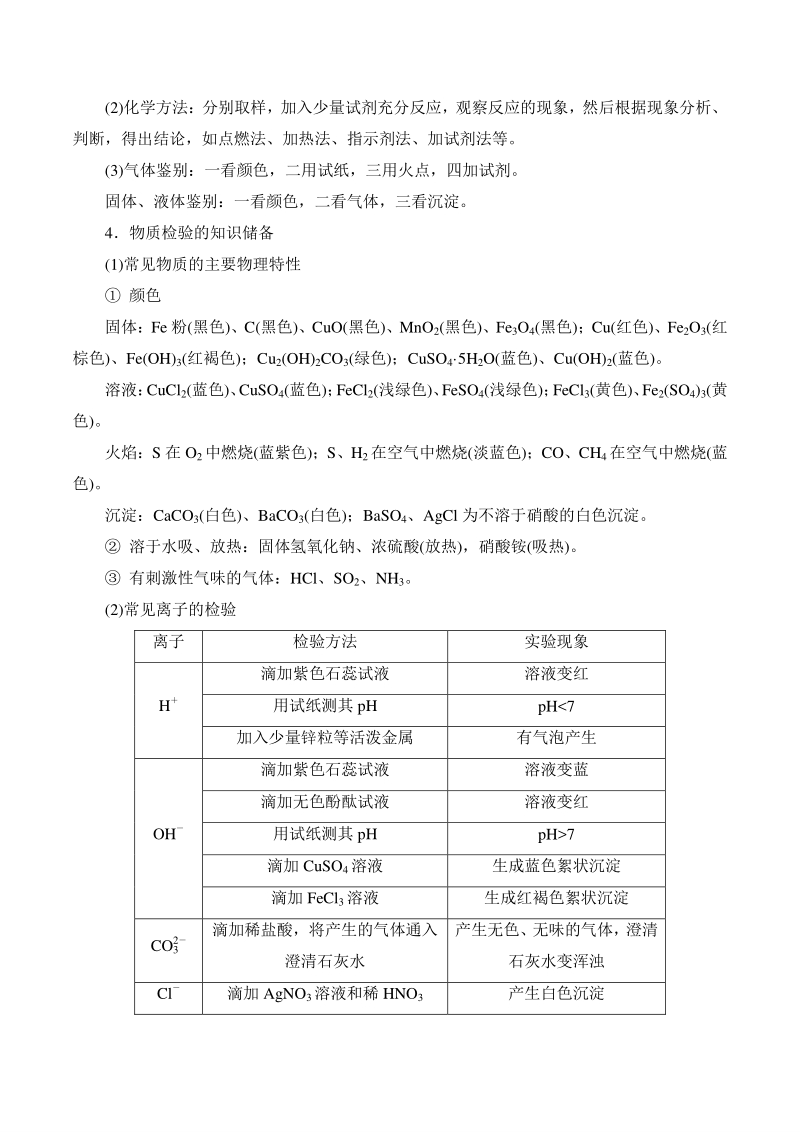
3、味法、水溶法、磁铁法等。 (2)化学方法:分别取样,加入少量试剂充分反应,观察反应的现象,然后根据现象分析、 判断,得出结论,如点燃法、加热法、指示剂法、加试剂法等。 (3)气体鉴别:一看颜色,二用试纸,三用火点,四加试剂。 固体、液体鉴别:一看颜色,二看气体,三看沉淀。 4物质检验的知识储备 (1)常见物质的主要物理特性 颜色 固体:Fe 粉(黑色)、C(黑色)、CuO(黑色)、MnO2(黑色)、Fe3O4(黑色);Cu(红色)、Fe2O3(红 棕色)、Fe(OH)3(红褐色);Cu2(OH)2CO3(绿色);CuSO4 5H2O(蓝色)、Cu(OH)2(蓝色)。 溶液: CuCl2(蓝色)
4、、 CuSO4(蓝色); FeCl2(浅绿色)、 FeSO4(浅绿色); FeCl3(黄色)、 Fe2(SO4)3(黄 色)。 火焰:S 在 O2中燃烧(蓝紫色);S、H2在空气中燃烧(淡蓝色);CO、CH4在空气中燃烧(蓝 色)。 沉淀:CaCO3(白色)、BaCO3(白色);BaSO4、AgCl 为不溶于硝酸的白色沉淀。 溶于水吸、放热:固体氢氧化钠、浓硫酸(放热),硝酸铵(吸热)。 有刺激性气味的气体:HCl、SO2、NH3。 (2)常见离子的检验 离子 检验方法 实验现象 H 滴加紫色石蕊试液 溶液变红 用试纸测其 pH pH7 滴加 CuSO4溶液 生成蓝色絮状沉淀 滴加 FeCl3
5、溶液 生成红褐色絮状沉淀 CO2 3 滴加稀盐酸,将产生的气体通入 澄清石灰水 产生无色、无味的气体,澄清 石灰水变浑浊 Cl 滴加 AgNO3溶液和稀 HNO3 产生白色沉淀 续表续表 离子 检验方法 实验现象 SO2 4 滴入稀盐酸酸化,再滴加 BaCl2 或 Ba(NO3)2溶液 酸化无现象,加 入 BaCl2或 Ba(NO3)2溶液后产生白色沉淀 NH 4 加入碱溶液加热,用湿润的红色 石蕊试纸检验产生的气体 产生有刺激性气味的气体,试纸 变蓝 Fe3 滴加碱溶液 产生红褐色絮状沉淀 Cu2 滴加碱溶液 产生蓝色絮状沉淀 插入铁丝 铁丝表面附有红色的固体 (3)常见气体的检验方法 气体
6、 检验方法 现象 氧气 将带火星的木条伸入集气瓶内 木条复燃 二氧化碳 将气体通入澄清的石灰水中 石灰水变浑浊 氢气 点燃,在火焰上方罩一个冷而干 的烧杯,然后迅速倒转烧杯,注 入澄清石灰水 烧杯内壁有水珠,澄清石灰水没 有变浑浊 一氧化碳 点燃,在火焰上方罩一个冷而干 的烧杯,然后迅速倒转烧杯,注 入澄清石灰水 烧杯内壁没有水珠,澄清石灰水 变浑浊 甲烷 点燃,在火焰上方罩一个冷而干 的烧杯,然后迅速倒转烧杯,注 入澄清石灰水 烧杯内壁有水珠,澄清石灰水变 浑浊 氨气 用湿润的红色石蕊试纸检验 试纸变蓝 难点解析:不用其他任何试剂的鉴别题,此类题型的鉴别方法一般有三种: 物理特征法:根据待鉴
7、别物质中,某一物质的物理特性(其他物质有不同的颜色、气味 等),先将其确定,然后利用该物质作为试剂,将剩余物质一一鉴别。 两两混合法:当无法利用物理性质入手时,往往可以采用两两混合的方法,若各自产生 不同的现象,即可加以区别。 利用产物法:如果利用以上两种方法依然不能鉴别,可以利用相关反应的产物作为已知 试剂进行进一步的鉴别。 二、 物质分离和提纯的原理 1物质的分离:通过适当的方法,把混合物中的各种物质彼此分开,并且恢复到各种物 质原来的存在状态,分别得到纯净的物质。 2物质的提纯:通过适当的方法,把混入某物质中的少量杂质除去,以便获得相对纯净 的物质,又称除杂。 注意:“分离”和“提纯”的
8、要求不同:前者要求把混合物中的各个成分分离开,各种成 分都要保留;后者则以除去杂质为目的,保留其主要成分。 3物质分离和提纯的方法与技巧 (1)物理方法 过滤法:a.固体与液体混合物的分离;b.可溶性固体与不溶性固体混合物的分离。如粗 盐的提纯,分离 KCl 和 MnO2混合物。 蒸馏法:利用物质沸点不同来分离互溶混合物,如工业上制取氧气。 结晶法:根据混合物中各组分在某一溶剂中的溶解度随温度变化的不同,可采用结晶 法除杂。如分离 NaCl 与 KNO3的混合物。 a蒸发结晶法:通过蒸发溶剂的方法使溶质析出,适用于溶解度受温度变化影响较小的 物质,如氯化钠。 b降温结晶法(或冷却热饱和溶液法)
9、:通过降低温度的方法使溶质析出,适用于溶解度 随温度升高而增大,且溶解度受温度变化影响较大的物质,如硝酸钾。 磁铁法:利用磁铁能吸引铁,可以把铁从其他不能被铁吸引的杂质中分离出来或从不 能被铁吸引的物质中把铁杂质除去。 (2)化学方法 化气法:在溶液中加入适量的试剂(酸),使所含杂质转化为气体除去,主要指碳酸盐, 所选的酸主要由主要成分的酸根决定,加入酸要适量。如除去 Na2SO4中的 Na2CO3,可加适量 稀 H2SO4。 沉淀法: 在溶液中加入试剂, 将杂质转化为沉淀过滤除去。 如除去 NaCl 中的 Na2SO4, 可加适量的 BaCl2。 置换法:利用金属活动性顺序除去某些盐溶液中所
10、含杂质(盐),将杂质通过置换反应 而除去。如除去 FeSO4中的 CuSO4,可加过量的铁粉,再过滤。 加热法:杂质受热易分解,通过加热将杂质除去,如除去 CaO 中的 CaCO3。 溶解法: 将杂质溶于某种试剂而除去, 如除去 C 粉中的 CuO 粉, 可加适量稀硫酸, 再过滤。 转化法:将杂质通过化学反应转化为主要成分,如除去 CO2中的 CO,可将气体通过 灼热的 CuO。 逆推法:当混合物中的杂质无法直接除去时,使用间接转化法除杂。如除去 CaCl2中 的 NaCl 杂质时,杂质 Na 无法除去,只能先加 Na 2CO3溶液,把 Ca2 转化为 CaCO 3沉淀,过 滤,洗涤得到 Ca


- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 第3部分 第15讲 物质的检验分离与提纯-2021届浙教版中考科学一轮复习讲解部分 部分 15 物质 检验 分离 提纯 2021 届浙教版 中考 科学 一轮 复习 讲解
 七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。



 浙公网安备33030202001339号
浙公网安备33030202001339号
链接地址:https://www.77wenku.com/p-180055.html